

隨著國內疫情防控成果向好,霍普金斯大學疫情數據時刻牽動著人們的心。我們逐步有生產能力保障對內供應并出口防疫物資,但好事多磨、一波三折,都不足以形容出口之路的溝溝坎坎
這個假期,經過輿論發酵(疫情所迫),歐盟發文決定免除從非歐盟國家進口醫療設備的關稅和增值稅,醫療器械MDR新規也延遲一年生效;美國FDA(類似中國的國家藥監局)發文批準KN95口罩有條件準入;中國國家認監委日期還公布了境內具備CE認證資質的認證機構名單。
轉眼間,出口之路不似豁然勝似開朗。
01歐盟:免除進口醫療用品及設備的關稅和增值稅
2020年3月20日,歐盟委員會邀請所有會員國以及英國,要求免征從第三國進口防護用品和其他醫療設備的關稅和增值稅。經協商討論,歐盟委員會主席Ursula von der Leyen于4月3日正式決定,暫時免征自第三國(即非歐盟國家)進口的醫療設備和防護設備的關稅和增值稅,以幫助抗擊新型冠狀病毒。

舉個例子:以歐盟從中國進口口罩為例,要征收6.3%的關稅和22%的增值稅,呼吸機的平均增值稅率為20%,免稅后大大降低采購商的進口價格壓力。
歐盟官方公告:
https://ec.europa.eu/commission/presscorner/detail/en/ip_20_575
免稅產品包括:
口罩等防護用品、新冠病毒檢測試劑、呼吸機和其他醫療設備。
免稅時效:
自2020年4月3日起6個月內,并有可能進一步延長。
免稅追溯時效:公告正文提到“Today's decision takes effect retroactively from 30 January.”意味著歐盟成員國在2020年1月30日至2020年4月2日期間,自他國進口上述產品的關稅和增值稅可申請退回,但公告未具體說明如何申請,小二君建議讓客戶咨詢相關機構如何追溯免稅。

小二君Tips:英國雖已脫歐,但2020年12月31日之前,依然適用歐盟法規。

02歐盟MDR新規延遲1年生效
隨著新型冠狀病毒在歐盟的影響范圍擴大,對成員國提出了前所未有的挑戰,為應對歐盟成員國對醫療器械的緊急需求,同時避免因現有醫療器械合格評定機構數量不足而出現物資短缺的風險,歐盟委員會將Medical Devices Regulation新規(簡稱MDR)的實施推遲一年至2021年5月26日,該法規原本計劃于2020年5月26日生效取代醫療器械舊指令MDD。
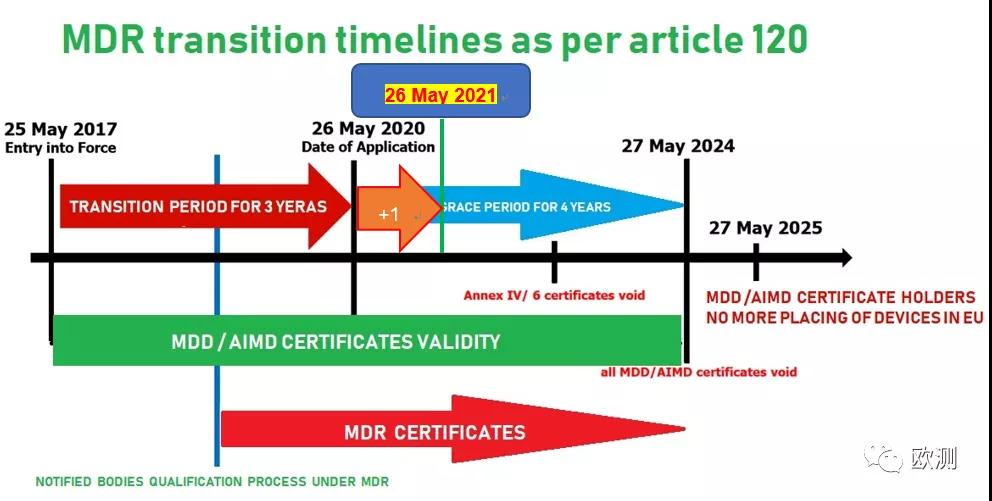
(圖源:歐測)
此決議深受醫療器械廠家以及尚未獲得MDR授權的認證機構歡迎。由于時間原因,原本大部分MDD機構最近兩個月已經停止受理MDD新申請,此決議之后大部分MDD機構將重啟受理認證。同時也給MDD機構轉換MDR提供了充足的過度時間。
受疫情影響推遲一年實施的還有歐盟有源植入式醫療器械指令"Directive on active implantable medical devices"。
不過,上述決定不會影響歐盟《體外診斷醫療器械法規》"In Vitro Diagnostics Medical Devices Regulation"的生效日期,該法規將于2022年5月26日生效。

03認監委:公布口罩等防疫用品CE認證機構名錄
4月5日,國家市場監管總局發布了口罩等防疫用品出口歐盟及美國市場認證信息指南,并公布《中國境內具有口罩等防疫用品CE認證能力的認證機構名錄》,以及《中國境內可以開展醫療器械管理體系(ISO13485)認證的機構名錄》:
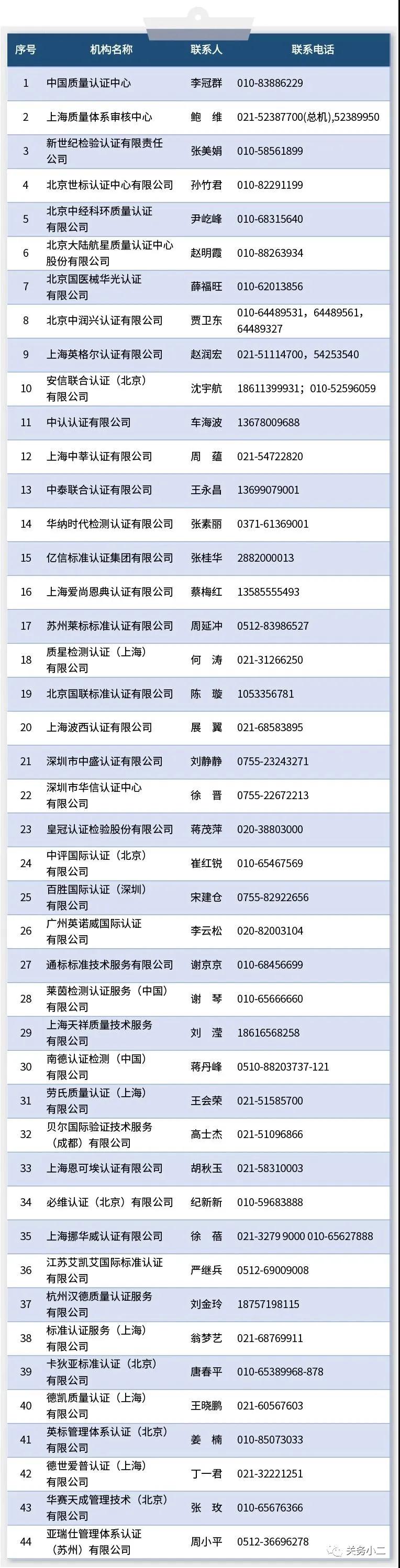
其中,具有CE認證能力的認證機構有8家,可以開展醫療器械管理體系(ISO13485)認證的機構有44家,并附上了各機構的聯系方式。
小二君溫馨提示:關于出口企業關心的CE認證業務辦理,比如認證時間、認證費用等具體問題,企業可詳細咨詢名單中的相關聯系人。
為做好新冠肺炎疫情防控和經濟社會發展工作,支持企業復工復產,針對企業不熟悉防疫物資出口政策等實際問題,現就口罩等防疫用品出口歐盟及美國的相關準入要求及梳理的國內具有相應資質能力的認證機構名錄提供如下信息指南,供企業參考。
一、歐盟對口罩等防疫用品準入要求(一)口罩
歐盟根據用途將口罩分為兩類:醫用口罩和個人防護口罩。
1.醫用口罩
醫用口罩需按照歐盟醫療器械指令93/42/EEC(MDD)或歐盟醫療器械條例EU2017/745(MDR)加貼CE標志,對應的標準是EN14683。根據口罩產品無菌或非無菌狀態,采取的合格評定模式也不同。
(1)無菌醫用口罩:必須由授權公告機構進行CE認證。
(2)非無菌醫用口罩:企業只需進行CE自我符合性聲明,不需要通過公告機構認證。在準備好相應文件及測試報告等資料后,即可自行完成符合性聲明。
2. 個人防護口罩
個人防護口罩不屬于醫療器械,但需符合歐盟個人防護設備條例EU2016/425(PPE)要求,由授權公告機構進行CE認證并頒發證書,對應的標準是EN149。
(二)防護服
防護服也分為醫用防護服和個人防護服,管理要求與口罩基本類似。醫用防護服按照醫療器械管理,其中無菌醫用防護服需按照歐盟醫療器械指令93/42/EEC(MDD)或歐盟醫療器械條例EU2017/745(MDR)獲得CE認證,非無菌醫用防護服只需進行CE自我聲明。個人防護服需按照歐盟個人防護設備條例EU2016/425(PPE)獲得CE認證。
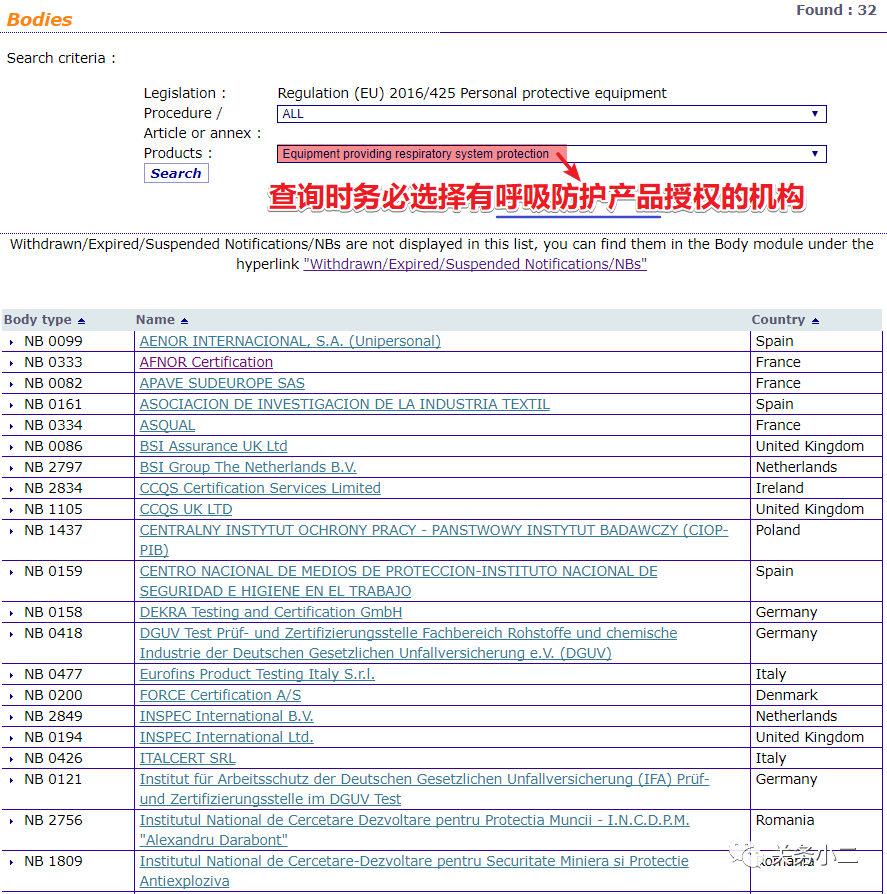
(三) 歐盟公告機構查詢地址
1.歐盟醫療器械指令93/42/EEC(MDD)授權的公告機構查詢地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13
2.歐盟醫療器械條例EU 2017/745(MDR)授權的公告機構查詢地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
3.歐盟個人防護裝備條例EU2016/425(PPE)授權的公告機構查詢地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=155501
關務小二Tips:以口罩為例,在查詢時務必下拉選擇"Equipment providing respiratory system protection",表示從名單中搜索具有呼吸器認證資質的認證機構。
二、美國對口罩等防疫用品準入要求(一)口罩
美國對醫用口罩和防護口罩同樣區分管理,其中醫用口罩由美國食品藥品監督管理局(FDA)管理,而個人防護口罩則由美國國家職業安全衛生研究所(NIOSH)管理。
最新消息!美國FDA已允許有條件將中國標準KN95口罩列入EUA緊急授權名單,可查看關務小二4月6日第二篇推文。
1. 醫用口罩
醫用口罩需通過FDA注冊,企業直接向FDA官網申請并提交相關材料。此外還有兩種可選途徑:
(1)已經獲得NIOSH注冊的N95口罩,在產品生物學測試、阻燃測試和血液穿透測試通過的情況下,可以豁免產品上市登記(510K),直接進行FDA工廠注冊和醫療器械列名。
(2)如果獲得持有510K的制造商的授權,可以作為其代工廠使用其510K批準號進行企業注冊和器械列名。
2. 個人防護口罩
防護口罩需通過NIOSH注冊,企業直接在NIOSH官網申請。
(二)防護服
對醫用防護服和個人防護服的管理也類似于口罩的管理方式,其中醫用防護服由美國食品藥品監督管理局(FDA)管理,而個人防護服由美國國家職業安全衛生研究所(NIOSH)管理。企業直接在FDA或NIOSH進行注冊申請。
三、中國境內具有口罩等防疫用品CE認證能力的認證機構名錄
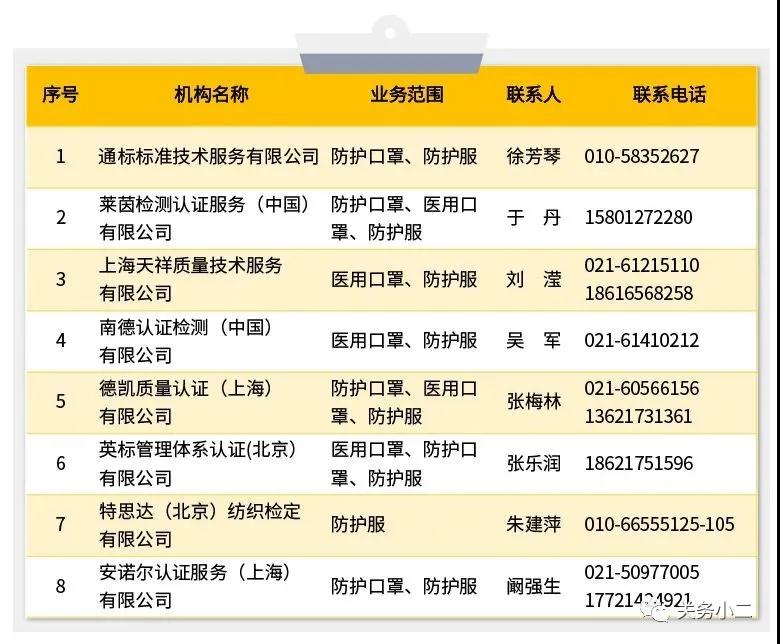
(如不在此名單請聯系市場監管局確認)
四、中國境內可以開展醫療器械管理體系(ISO13485)認證的機構名錄
04虛假認證、買賣認證行為將被重點打擊
4月5日,市場監管總局發布關于開展口罩、防護服等防疫用品領域認證活動專項整治行動的通知,決定自即日起,重點打擊虛假認證、買證賣證等認證違法行為。
市場監管總局關于開展口罩、防護服等防疫用品領域認證活動專項整治行動的通知
各省、自治區、直轄市及新疆生產建設兵團市場監管局(廳、委):
新冠肺炎疫情發生以來,相關認證機構積極服務口罩、防護服等防疫用品生產企業,充分發揮質量認證市場經濟“信用證”、國際貿易“通行證”作用,在幫助防疫用品順利進入國際市場中發揮了積極作用。
但也有個別機構肆意牟利、虛假認證甚至買證賣證,給企業造成了經濟損失,擾亂了認證市場秩序,更影響了口罩、防護服等防疫用品順利出口。
為有力支持全球抗擊疫情工作,規范認證市場秩序,現決定自即日起,市場監管部門開展口罩、防護服等防疫用品領域認證活動專項整治行動,重點打擊虛假認證、買證賣證等認證違法行為。現將有關事項通知如下。
一、工作目標
圍繞社會輿論突出反映的口罩、防護服等防疫用品虛假認證、買證賣證等問題,加大認證監管力度,嚴厲打擊涉及防疫用品的認證違法行為,提升認證實施有效性,不斷規范認證市場。
二、工作重點
(一)重點查處偽造、冒用、非法買賣認證證書和認證標志的違法行為。通過重點摸查轄區內口罩、防護服等防疫用品生產企業獲得認證情況,及時發現相關認證違法違規行為線索。
(二)重點查處未經批準擅自在我國境內從事認證活動的違法行為。對發現的非法認證線索,及時進行核查處理并上報市場監管總局,由總局向社會發布警示信息。
(三)重點檢查認證機構認證活動不規范的問題。針對經批準的認證機構,重點對其口罩、防護服等防疫用品領域認證活動進行檢查,不斷規范認證行為。
(四)重點檢查認證價格違法問題。對發現的認證市場哄抬價格、串通漲價、價格欺詐等違法行為,嚴格按照《價格法》《價格違法行為行政處罰規定》依法依規嚴肅查處。
三、工作要求
(一)加強領導,迅速部署。各地市場監管部門要迅速行動,研究制定針對性強的監管措施,組織精干力量,全面加大認證執法力度。同時積極引導幫扶企業選擇合法合規認證機構進行相關認證。
(二)拓寬渠道,主動作為。各地市場監管部門要暢通全國12315平臺、12315專用電話,積極利用監督檢查、受理投訴舉報、輿情監測、企業摸查等多種渠道,深挖細查認證違法案件線索。
(三)從快辦理,綜合執法。對口罩、防護服等防疫用品相關的認證違法案件,要按照《市場監管總局關于依法從重從快嚴厲打擊新型冠狀病毒疫情防控期間違法行為的意見》(國市監法〔2020〕27號)優先加快辦理,從重處罰。要關注認證行為、認證服務價格、認證宣傳、產品質量等方面違法行為的關聯性,加強綜合執法。
(四)注重銜接,聯動打擊。要注重與公安、海關、藥監等部門的銜接和協調,對涉嫌犯罪的及時移交公安部門,對涉嫌違法認證的出口產品信息及時通報海關部門,對醫療器械質量標準問題及時通報藥監部門。
(五)主動發聲,廣泛宣傳。各級市場監管部門要充分利用電視、廣播、網絡等傳播渠道,廣泛開展宣傳,曝光典型案例,震懾認證違法違規行為。
各地市場監管部門要做好組織協調工作,指定專門的聯絡員,及時向上級部門報送信息。各省(區、市)市場監管部門應在2020年6月30日前將專項整治工作情況報市場監管總局認證監管司。
聯系郵箱:renzhengjiandu@samr.gov.cn
市場監管總局
2020年4月3日
(來源:關務小二)
以上內容屬作者個人觀點,不代表雨果網立場!如有侵權,請聯系我們。